- Megamozg 2205 б
- Matalya1 1800 б
- DevAdmin 1720 б
- arkasha_bortnikov 900 б
- Dwayne_Johnson 870 б
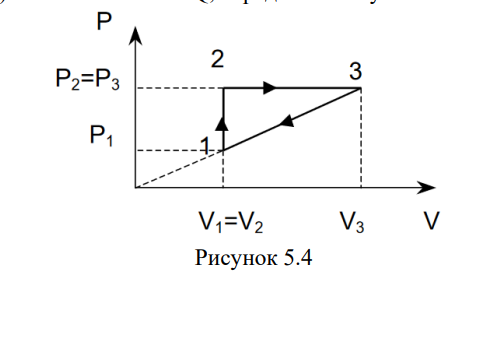
Идеальный газ совершает циклический процесс, представленный на рисунке 5.4. Температуры газа в состояниях 1 и 3 равны Т1 = 300 К и Т3 = 400 К соответственно. Определить: 1) температуру газа в состоянии 2; 2) совершенную им работу A; 3) количество тепла Q, переданное газу. газ кислород T1=300 К; T3 = 500 К; V1 = 1 м3 , V3 = 3 м3 , Р1 = 2·105 Па, Р2 = 5·105 Па
Для решения задачи нам понадобятся первый и второй законы термодинамики:
1) Первый закон термодинамики:
dU = dQ - dA, где dU - изменение внутренней энергии газа, dQ - переданное газу количество тепла, dA - совершенная газом работа.
2) Второй закон термодинамики:
dS >= dQ/T, где dS - изменение энтропии газа, T - температура газа.
Используя эти законы, найдем:
1) Из уравнения состояния идеального газа PV=nRT следует, что P1V1/T1=P2V2/T2=P3V3/T3. Значит, T2=P2V2T1/(P1V1)=5*10^5*1*300/(2*10^5*0.5)=750 К.
2) Совершенная работа A равна площади, ограниченной циклом на графике PV:
A = (P2V2 - P1V1) + (P3V3 - P2V2) = (5*10^5*1 - 2*10^5*1) + (3*10^5*3 - 5*10^5*1) = -400000 Дж.
Отрицательный знак означает, что работа совершена над газом.
3) Из первого закона термодинамики следует, что dQ = dU + dA. Изменение внутренней энергии dU для циклического процесса равно нулю (так как внутренняя энергия зависит только от температуры). Значит, dQ = dA = -400000 Дж. Отрицательный знак означает, что газ поглощает тепло.
Ответ: 1) T2 = 750 К; 2) A = -400000 Дж; 3) Q = -400000 Дж.
Для решения задачи нам понадобятся первый и второй законы термодинамики:
1) Первый закон термодинамики:
dU = dQ - dA, где dU - изменение внутренней энергии газа, dQ - переданное газу количество тепла, dA - совершенная газом работа.
2) Второй закон термодинамики:
dS >= dQ/T, где dS - изменение энтропии газа, T - температура газа.
Используя эти законы, найдем:
1) Из уравнения состояния идеального газа PV=nRT следует, что P1V1/T1=P2V2/T2=P3V3/T3. Значит, T2=P2V2T1/(P1V1)=5*10^5*1*300/(2*10^5*0.5)=750 К.
2) Совершенная работа A равна площади, ограниченной циклом на графике PV:
A = (P2V2 - P1V1) + (P3V3 - P2V2) = (5*10^5*1 - 2*10^5*1) + (3*10^5*3 - 5*10^5*1) = -400000 Дж.
Отрицательный знак означает, что работа совершена над газом.
3) Из первого закона термодинамики следует, что dQ = dU + dA. Изменение внутренней энергии dU для циклического процесса равно нулю (так как внутренняя энергия зависит только от температуры). Значит, dQ = dA = -400000 Дж. Отрицательный знак означает, что газ поглощает тепло.
Ответ: 1) T2 = 750 К; 2) A = -400000 Дж; 3) Q = -400000 Дж.