Лучшие помощники
- Megamozg 2205 б
- Matalya1 1800 б
- DevAdmin 1720 б
- arkasha_bortnikov 900 б
- Dwayne_Johnson 870 б
16 декабря 2022 08:24
908
Нужен конспект по сере.Тема «Сера, ее физические и химические свойства»
1. Сера как химический элемент:
• Положение в периодической таблице
• Строение атома
• Способность отдавать и принимать электроны на последний слой
• Нахождение в природе
• История открытия
2. Сера как простое вещество
• Формула
• Строение простого вещества (тип связи, тип кристаллической решетки)
• Аллотропные модификации серы (кристаллическая и пластическая), их физические свойства
• Химические свойства серы как окислителя и восстановителя (с металлами, водородом, кислородом, хлором, серной кислотой)
• Получение
• Применение
1
ответ
S - сера
Сера в самородном состоянии, а также в виде сернистых соединений известна с древнейших времён. Элементарную природу серы установил Лавуазье в опытах по сжиганию
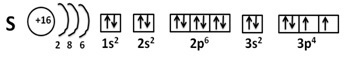
3 малый период, VI группа, главная подгруппа.
(Электронно-графическая формула в фото 1)
Степень окисления: -2, 0, +4,+6
Валентность: IV, VI
Высший оксид: SO3, летучее водородное соединение: H2S
Неметалл
Нахождение в природе:
- в самородном виде:
Cера встречается в природе в свободном (самородном) состоянии, поэтому она была известна человеку уже в глубокой древности.
- в виде соединений:
PbS – свинцовый блеск,
ZnS – цинковый блеск (цинковая обманка)
FeS2 – пирит (серный колчедан)
HgS – киноварь
Для серы характерно явление аллотропии.\
Ромбическая сера – это наиболее устойчива модификация, состоит из молекул S8. Кристаллы имеют лимонно-желтый цвет и полупрозрачны, Tпл.= 112,8 °С.
Моноклинная сера имеет вид желтых игольчатых кристаллов, Tпл.= 119,3 °С.
Пластическая сера – Вязкая тёмно-коричневая масса, которая через несколько дней снова превращается в ромбическую.
Химические свойства:
Сера в химических реакциях проявляет окислительные и восстановительные свойства.
1. Сера взаимодействует с металлами. При этом образуются соли - сульфиды:
2Al + 3S → Al2S3 (сульфид алюминия)
Cu + S → CuS (сульфид меди (II))
Hg + S → HgS (сульфид ртути (II))
2. При повышенной температуре реагирует с водородом:
S + H2→ H2S (сероводород)
3. Сера горит в кислороде голубоватым пламенем.
S + O2→ SO2 (оксид серы (IV))
4. Сера реагирует с галогенами:
S + 3F2 → SF6
Основные отрасли применения:
- для производства серной кислоты
- для производства бенгальских огней
- для производства бумаги
- Изготовление веществ для удобрения растений.
- Получения цветных металлов.- Для придачи стали дополнительных свойств.- Для изготовления спичек, материалов для взрывов и пиротехники.- Для производства краски, волокон - Для отбеливания ткани.получение:самородную серу добывают непосредственно из пластов в недрах земли. Ее потом очищают разными методами.
Сера в самородном состоянии, а также в виде сернистых соединений известна с древнейших времён. Элементарную природу серы установил Лавуазье в опытах по сжиганию
3 малый период, VI группа, главная подгруппа.
(Электронно-графическая формула в фото 1)
Степень окисления: -2, 0, +4,+6
Валентность: IV, VI
Высший оксид: SO3, летучее водородное соединение: H2S
Неметалл
Нахождение в природе:
- в самородном виде:
Cера встречается в природе в свободном (самородном) состоянии, поэтому она была известна человеку уже в глубокой древности.
- в виде соединений:
PbS – свинцовый блеск,
ZnS – цинковый блеск (цинковая обманка)
FeS2 – пирит (серный колчедан)
HgS – киноварь
Для серы характерно явление аллотропии.\
Ромбическая сера – это наиболее устойчива модификация, состоит из молекул S8. Кристаллы имеют лимонно-желтый цвет и полупрозрачны, Tпл.= 112,8 °С.
Моноклинная сера имеет вид желтых игольчатых кристаллов, Tпл.= 119,3 °С.
Пластическая сера – Вязкая тёмно-коричневая масса, которая через несколько дней снова превращается в ромбическую.
Химические свойства:
Сера в химических реакциях проявляет окислительные и восстановительные свойства.
1. Сера взаимодействует с металлами. При этом образуются соли - сульфиды:
2Al + 3S → Al2S3 (сульфид алюминия)
Cu + S → CuS (сульфид меди (II))
Hg + S → HgS (сульфид ртути (II))
2. При повышенной температуре реагирует с водородом:
S + H2→ H2S (сероводород)
3. Сера горит в кислороде голубоватым пламенем.
S + O2→ SO2 (оксид серы (IV))
4. Сера реагирует с галогенами:
S + 3F2 → SF6
Основные отрасли применения:
- для производства серной кислоты
- для производства бенгальских огней
- для производства бумаги
- Изготовление веществ для удобрения растений.
- Получения цветных металлов.- Для придачи стали дополнительных свойств.- Для изготовления спичек, материалов для взрывов и пиротехники.- Для производства краски, волокон - Для отбеливания ткани.получение:самородную серу добывают непосредственно из пластов в недрах земли. Ее потом очищают разными методами.
0
·
Хороший ответ
18 декабря 2022 08:24
Остались вопросы?
Еще вопросы по категории Химия
3,4-диметилгексан 2,4-диметилпентан...
Вычислите относительную массу метана CH4...
написать структурную формулу всех изомеров аминов: C4H9N и C6H11N и дать им название) если можно,на листочке формулы...
После пропускания 4,48 л серного газа через 632 г раствора гидроксида калия получили раствор средней соли. Вычислите массовую долю соли в полученном р...
Осуществите превращения:метан-ацетилен-бензол-хлорбензол-фенол-фенолят....